Selamat pagi, siang, sore, malam agan semua yang berada di dunia ini maupun di dunia lain (ngaco)
&space;\thinspace&space;Tentukan&space;\thinspace&space;jumlah&space;\thinspace&space;mol&space;\thinspace&space;zat&space;\thinspace&space;yang&space;\thinspace&space;berada&space;\thinspace&space;pada)
&space;\thinspace&space;18\thinspace&space;gram\thinspace&space;H_{2}O)
![b.) \thinspace 30\thinspace gram\thinspace urea\thinspace \thinspace [CO(NH_2)_2]](http://latex.codecogs.com/png.latex?\large&space;b.)&space;\thinspace&space;30\thinspace&space;gram\thinspace&space;urea\thinspace&space;\thinspace&space;[CO(NH_2)_2])
&space;\thinspace&space;28.7\thinspace&space;gram\thinspace&space;perak\thinspace&space;klorida\thinspace\thinspace&space;(AgCl))
kali ini ane mau ngebahas tentang kimia kelas X yaitu stoikiometri.
Ane sebenarnya masih kelas X, tapi karena ane gemar kimia, ane diikutsertakan OSK nantinya, doain ane ya gan (ceritanya curcol)..
Yaudah tanpa ba bi bu langsung aja ke soal
Jawab :
a.) Ingat! Untuk mencari mol senyawa, kalian bisa memakai rumus
}{massa\thinspace&space;molar&space;\thinspace&space;senyawa&space;\thinspace&space;(gram/mol)})
cari massa molar 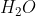 = H2O terlebih dahulu
= H2O terlebih dahulu
Massa Molar 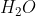 = (2 x Massa Atom H = 2 x 1 = 2) + ( 1 x Massa
= (2 x Massa Atom H = 2 x 1 = 2) + ( 1 x Massa
Atom O = 1 x 16 = 16) = 18 g/mol
Atom O = 1 x 16 = 16) = 18 g/mol
mol 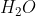 = 18gram/(18 gram / mol)
= 18gram/(18 gram / mol)
mol 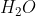 = 1 mol
= 1 mol
b.) Urea = CO(NH2)2
massa molar urea = M.atom C + M.atom O + 2x(M.Atom N + 2 x M.Atom H)
12 + 16 + 2x(14 + 2x1) ; 28 + 2x(16) ; 28 + 32 = 60
mol urea = 30 gram / 60 (gram/mol) = 0.5 mol (dalam stoikiometri, sebaiknya gunakan desimal)
c.) Perak klorida = AgCl
Massa molar AgCl = 108 + 35,5 = 143.5
mol perak klorida : 28.7 gram/ 143.5 (gram/mol) ; 0,2 mol
jadi, jumlah mol 28,7 gram perak klorida = 0.2 mol
2.) Tentukan banyak molekul yang terdapat pada .... Diketahui Bilangan Avogadro = 6.02x10^23
a.) 11 gram garam dapur (NaCl)
b.) 20 gram asam asetat (CH3COOH)
c.) 92 gram asam sulfat (H2SO4)
Jawab :
perlu agan semua ketahui bahwa mol tidak sama dengan molekul, moleku memiliki rumus :
Banyak molekul = Na x mol dimana bilangan avogadro 6,02 x 10^23 molekul/mol
jadi terlebih dahulu carilah jumlah mol semuanya
a.) mol NaCl = 11 gram / (23 + 35,5)(gram/mol)
mol NaCl = 0.2 (pembulatan)
maka banyak molekul = 0.2 x 6,02x10^23 = 1,204 x 10^23 molekul
b.)mol asam asetat = 20 / 12+3+12+32+1 = 20gram / 60 (gram/mol) = 0,3 mol
maka banyak molekul = 0.3 mol x 6,02 x 10^23 molekul/mol = 1.806 x 10^23 molekul
c.)mol asam sulfat = 90/2+32+64 = 90gram / 98(gram/mol) = 0,9 mol (pembulatan)
maka banyak molekul = 0.9mol x 6,02 x 10^23molekul/mol = 5,148 molekul
3.) Tentukan massa dari
1. 1 mol Natrium sulfat (Na2SO4) Massa molar = 142 g/mol
2. 0,3 mol Kalium hidroksida (KOH) Massa molar = 40 g/mol
3. 0,1 mol asam klorida (HCl) Massa molar = 36,5 g/mol
Jawab : Tinggal di balik saja prosesnya
a.)massa natrium sulfat = mol x massa molar ; 1 mol x (142gram/mol) = 142 gram
b.)massa KOH = 0,3 mol x 40g/mol = 12 gram
c.)massa HCl = 0,1 mol x 36,5g/mol = 3,65 gram
4.) Tentukan massa dari
a.) 3,01 x 10^23 atom gas N2 (M molar = 28)
b.) 1,204 x 10^23 atom KCl (M molar = 36,5)
Jawab = Balikan reaksi dari soal no 2
a.) mol = molekul / bilangan avogadro
mol N2 = 3,01x10^23 molekul / 6,02x10^23 molekul/mol = 0,5 mol
massa N2 = 0,5 mol x 28 g/mol = 14 gram
b.) mol HCl = 1,204x10^23 molekul / 6,02 x 10^23 molekul/mol = 0,2 mol
massa HCl = 0,2 mol x 36,5 g/mol = 7,3 gram.
Sekian dulu dari ane, kalau ada pertanyaan/ request soal, bisa meninggalkan komentar di bawah, insyaallah ane bantu. Terima kasih telah visit blog ane
Wassalam....
Terimakasih untuk soal dan ilmunya gan
BalasHapus